La fisiopatología de la sepsis es compleja e involucra múltiples aspectos de la interacción entre los microorganismos infectantes y el huésped (múltiples tipos celulares, tejidos, órganos y sistemas) [1]. La sepsis es considerada una respuesta inflamatoria aguda desordenada, no resolutiva y finalmente deletérea que se pone en marcha cuando el huésped con factores predisponentes sufre una infección o invasión por un microorganismo patógeno con capacidad para activar dichos mecanismos [2]. En condiciones normales, estos patógenos, son reconocidos por los receptores de las células del sistema inmunitario del huésped. La respuesta específica en cualquier paciente depende del patógeno causal (de su carga y de su virulencia) y del huésped (de sus características genéticas y de enfermedades coexistentes) con una respuesta diferencial a nivel local, regional y sistémico. La composición y dirección de la respuesta del huésped cambia en el tiempo al igual que el curso clínico [3]. Una respuesta eficiente puede erradicar al agente etiológico con mayor o menor daño colateral inflamatorio local y/o sistémico, sin embargo, su alteración conlleva la posibilidad de inducir un daño relevante al propio huésped y permitir la progresión y/o cronificación de la infección. En general la reacción proinflamatoria (dirigida a eliminar el patógeno invasor) es responsable del daño colateral en los tejidos, mientras que la respuesta antiinflamatoria es importante para limitar el daño local y sistémico, estando esta implicada en una mayor susceptibilidad a las infecciones secundarias [4].
Factores predisponentes a la infección.
Existen diversos factores que influyen en la capacidad defensiva del huésped frente a los agentes infecciosos, estos incluyen elementos estructurales y funcionales relacionados con la dotación genética y edad del huésped, su estado nutricional, la función de sus distintos órganos, y componentes neuroendocrinos que modulan el sistema inmune. Cualquier alteración en los mecanismos de defensa facilita la infección: alteración de piel y mucosas, canalización de vías endovenosas, procedimientos intravasculares, intervenciones quirúrgicas, etc., todo esto facilita la entrada de gérmenes en el organismo. Por otra parte, la disminución del número de Neutrófilos o alteración de su función y la deficiencia de componentes del complemento facilita la infección por parte de gérmenes que son destruidos por fagocitosis, o alteración en la producción de anticuerpos. La alteración cuantitativa y funcional de Linfocitos T y de células citotóxicas facilitan la infección de gérmenes intracelulares, algunas veces son de carácter congénito y otras adquirido, entre estas últimas destacan insuficiencia hepática o renal, neoplasias, Diabetes Mellitus o desnutrición. No podemos olvidar que numerosos fármacos tienen actividad inmunosupresora como los utilizados para el control de rechazo de órganos trasplantados, tratamientos oncológicos y autoinmunes. El estado de inmunodeficiencia también puede ser debido a otras iatrogenias inducidas por procesos anestésicos y quirúrgicos, radioterapia, transfusiones sanguíneas, etc. Por último, la presencia de lugares con medidas higiénicas deficientes, ingresos hospitalarios o estancias en zonas geográficas con diferentes características epidemiológicas también favorecen las exposiciones a agentes potencialmente patológicos [5].
Respuesta inmunitaria frente a la infección
Dentro de la respuesta inmunitaria distinguimos la innata y la adaptativa. La respuesta innata se inicia tras la penetración del microorganismo produciéndose la activación de péptidos antimicrobianos (Defensinas, Catelicidinas, etc.), sistema del complemento, sistema de Cinininas y se produce la interacción con las diferentes células fagocitarias (Neutrófilos, Monocitos, Macrófagos y Células Dendríticas) [5].
Estas interacciones se producen por la expresión en los microorganismos patógenos de distintos tipos de estructuras moleculares denominados Patrones moleculares asociados a patógenos (PAMP). Podemos encontrar diferentes PAMPs (Figura 1): lipopolisacáridos en bacterias Gram negativas, ácido lipoteicoico en bacterias Gram positivas y zymosan (?-D glucano) en hongos [6]. Los PAMP son reconocidos por los Receptores de patrones solubles (PRR) que están situados en las células de respuesta inmunitaria innata o inflamatoria. Se han descrito varias familias de PRR [7]:
- Lecitinas tipo C receptoras, reconocen carbohidratos en superficies celulares, así como proteínas glicosiladas presentes en la superficie de patógenos, sangre y tejido intersticial. Funcionan como receptores al servicio de la fagocitosis. También sirven como moléculas de adhesión intercelular, comportándose como ligandos de integrinas.
- Receptores tipo Toll, una de las familias más estudiadas son los Toll-like receptors (TLR). Presentes en la membrana citoplasmática y en diversas organelas, son proteínas transmembrana cuya principal función es poner en marcha la cascada de señalización intracelular. Los TLR están presentes en Macrófagos, Mastocitos, Linfocitos T y B, en células endoteliales y en células de del parénquima de diferentes órganos. Los principales ligandos de los TLR son estructuras habituales en las bacterias como peptidoglicanos, lipopéptidos o lipopolisacáridos (endotoxinas bacterianas) o proteínas como la Flagelina. Los TLR situadas en membranas de vesículas intracelulares reconocen RNA virales o secuencias de DNA bacteriano.
- Receptor of advanced glycation end products (RAGE), es un receptor de membrana presente en células hematopoyéticas y parenquimatosas, pertenece al grupo de las inmunoglobulinas.
- Receptores citosólicos NLR (NOD like receptors), cuando interaccionan sus ligandos se forman oligómeros de NLR. Los distintos NLR tienen diferentes funciones según el tipo de dominio efector: APAF 1, forma el Apoptosoma, posibilitando la activación de la Caspasa-9, y poniendo en marcha la ruta endógena de apoptosis dependiente de Caspasas; NOD1 y NOD 2, detentan peptidoglicanos bacterianos, su oligomerización pone en marcha la activación de las MAP-cinasas y NF-kB, produciendo citoquinas proinflamatorias y la facilitación de la presentación a antígenos; por último NLR, forman plataformas moleculares denominadas Inflamasomas, cuando las proteínas NLRP3 localizan alguno de sus ligandos se asocian con proteínas adaptadoras, capacitando la unión con la Procaspasa-1, activando la Caspasa activa-1. Esta proteasa actúa sobre las formas inactivas de pro-IL-1B y pro- IL-18 y las activa, produciendo efectos proinflamatorios.
- Receptores citosólicos RLH helicasas tipo RIG, son sensores citoplasmáticos de RNA viral de doble cadena, que complementan la labor de TLR-3. Su activación desencadena la activación de NF-kB e IRF3/7, los cuales cooperan en la inducción de Interferones de tipo I con marcada actividad viral.
Cuando se produce la interacción entre el PAMP y los distintos PRR genera una señal que induce la activación celular, secretando Citocinas proinflamatorias e inmunoreguladoras, Interferón y Quimioquinas que regulan el tipo, intensidad y duración de la respuesta inflamatoria; contribuyendo al desarrollo de la respuesta adaptativa [5].

Figura 1. Modelo de PAMPs y DAMPs durante las infecciones. Imagen extraída de Rosin et al. [8].
La respuesta adaptativa humoral especifica se desencadena al ser detectados los antígenos de los microorganismos por los Linfocitos T y las inmunoglobulinas de los Linfocitos B (Figura 2).
Las Células Dendríticas y Monocitos realizan una presentación antigénica a los Linfocitos T helper activándolos. Las células T helper (CD4+), pueden ser categorizadas como T helper tipo 1 (Th1) o tipo 2 (Th2). Las Th1 generalmente secretan citoquinas proinflamatorias como: TNF? e IL1?. Las Th2 secretan citoquinas antinflamatorias como IL4 e IL10. El predominio de Th1 sobre Th2 o viceversa, dependerá del microorganismo infectante, de la carga de la infección y de otros factores [9].
La expansión clonal de Linfocitos T helper contribuye a la proliferación y maduración de Linfocitos T citotóxicos que producen lisis de las células infectadas, además activan Linfocitos B que secretan inmunoglobulinas que bloquean al microorganismo y sus productos patogénicos, activando el sistema de complemento que favorece su opsonización y fagocitosis. Las Citoquinas producidas interfieren en la regulación de la respuesta inflamatoria, ya que son las responsables mediante su acción en el endotelio y a nivel mitocondrial, de la vasoplejia asociada al cuadro séptico, así como las dificultades para el aprovechamiento del oxígeno aportado [5]. Las Citoquinas más importantes destacadas en la sepsis son:
- Factor de necrosis tumoral alfa (TNF ), los estímulos para la liberación de este mediador incluyen los PAMP, la fracción C5a del complemento, La IL1 y el mismo TNF . Tiene capacidad procoagulante y estimula la liberación de otras Citoquinas. Sus niveles plasmáticos aumentan precozmente durante la sepsis y disminuyen después de unas horas.
- Interleuquina 6 (IL 6), no induce por si sola las características del SRIS, a diferencia del TNF , su concentración plasmática se mantiene elevada a lo largo del proceso séptico. Provoca la producción hepática de reactantes de fase aguda e interviene en la diferenciación de Linfocitos B, la activación de Linfocitos T y la liberación de Factor tisular.
En la sepsis existe linfopenia (previa o inducida por la propia enfermedad). Esta situación afecta a todos los tipos de células T (CD4, CD8 y NK) excepto a las células T reguladoras, favoreciéndose así la inmunosupresión [10].
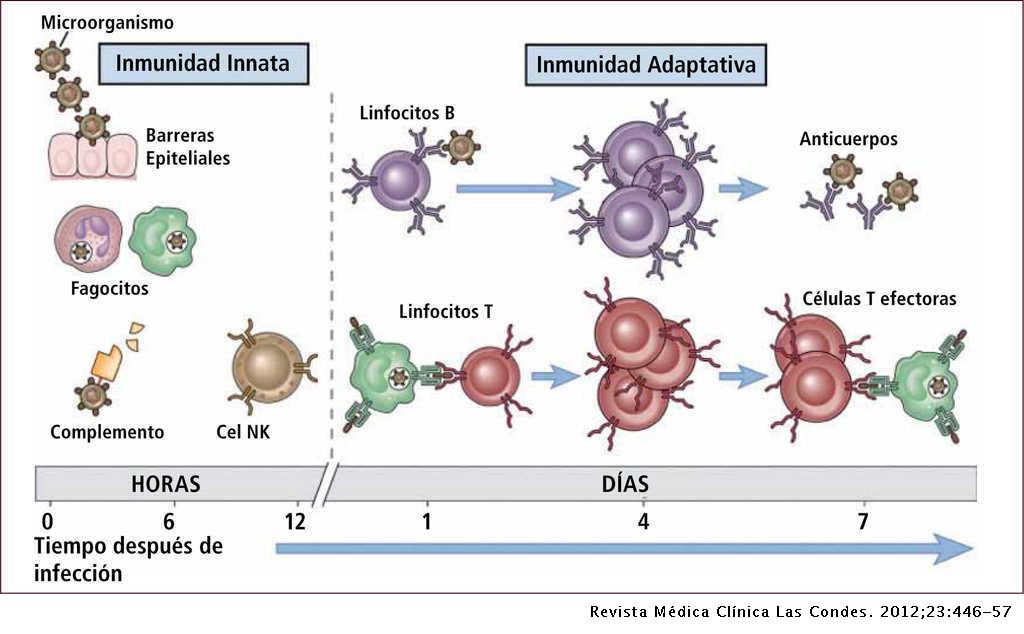
Figura 2. Respuesta inmune innata y adaptativa. Imagen extraída de Abbas et al [11].
Al mismo tiempo que se activan estos mecanismos, se inician mecanismos antiinflamatorios compensatorios que buscan frenar y controlar la respuesta inflamatoria. Cuando estos mecanismos compensatorios o inhibitorios fallan, se produce un exceso de actividad citotóxica y apoptosis que expone patrones moleculares asociados a daño celular denominados Patrones moleculares asociados al daño (DAMP) o Alarminas, entre las que destacan: Proteína del grupo B1 de alta movilidad, Proteína S100, RNA extracelular, DNA e Histonas. Las Alarminas son también liberadas durante el daño estéril como el trauma. Con lo que se demuestra que la patogénesis del fallo multiorgánico en la sepsis no es diferente de otras formas de enfermedades críticas no infecciosas [12, 13]. Los DAMP son reconocidos por los mismos receptores, retroalimentando y perpetuando una respuesta inflamatoria inadecuada.
Todo este conjunto de eventos genera una respuesta inflamatoria que puede controlar la infección, pero paradójicamente la respuesta inflamatoria del huésped también es el sustrato de los cambios fisiopatológicos en la sepsis.
Lesión vascular, alteración de coagulación y efectos sobre órganos y sistemas.
El primer cambio que se percibe como reacción a la actuación del agente causante de la inflamación, es de carácter vascular. Varios de los mediadores comentados tienen efectos vasoactivos, promoviendo la vasodilatación y aumento de la permeabilidad vascular (Figura 3). El endotelio vascular en condiciones normales presenta un estado anticoagulante. Sin embargo, en la sepsis se produce un cambio en el endotelio, provocando un desequilibrio entre los factores procoagulantes y anticoagulantes, a favor de los procoagulantes [9], de esta manera se acelera la pérdida de fluidos a través de las uniones celulares, aumentando el reclutamiento, la adhesión y la extravasación de células inflamatorias. La activación de la cascada de coagulación potencia la inflamación y completa el círculo vicioso en el que se incrementa la coagulopatía y se exacerba la lesión endotelial [12, 14].
La propia respuesta inflamatoria participa en la activación de la coagulación mediada por el Factor tisular (glicoproteína transmembrana) generando, por un lado, un exceso de depósito de fibrina, y por otro se produce una disminución de Trombomodulina y de receptores de Proteína C activada y de Antitrombina, que tiene como consecuencia la inadecuada eliminación de fibrina [9, 15]. En pacientes con sepsis encontramos coagulación intravascular diseminada (CID) en un 35% de los casos [16]. Esto genera, en primer lugar, un estado protrombótico con formación de coágulos en la microcirculación, amplificándose el daño tisular y comprometiendo la oxigenación tisular a pesar de que el gasto cardiaco se siga mantenido, provocando una disfunción mitocondrial y una alteración del aporte y consumo de oxígeno a nivel celular. En segundo lugar, y como consecuencia de todo lo anterior, aparecen hemorragias por consumo de factores de coagulación y plaquetopenia [17].
Todo este proceso inflamatorio generado en respuesta al cuadro séptico es seguido de una respuesta antinflamatoria, conocido como Síndrome de respuesta antinflamatoria compensadora (CARS) o inmunoparálisis. Sus objetivos son múltiples, el primero de ellos es inhibir la expresión de los genes que codifican la producción de citoquinas proinflamatorias (sobre todo IL 1 y TNF ), en segundo lugar inhibir la presentación antigénica y por ultimo disminuir la producción de especies reactivas de oxigeno (ERO), también conocidos como radicales libres producidos por el oxígeno. Todo esto se lleva a cabo gracias a la producción de Interleuquinas antiinflamatorias, sobre todo IL 4, IL 10, IL 13, el antagonista del receptor de la IL 1 (IL 1ra) y TGF . La aparición de estas Interleuquinas durante el CARS provoca la desactivación de los Monocitos, la entrada en un periodo de anergia de los Linfocitos T y la aparición de fenómenos de apoptosis celular, sobre todo de células endoteliales [5].
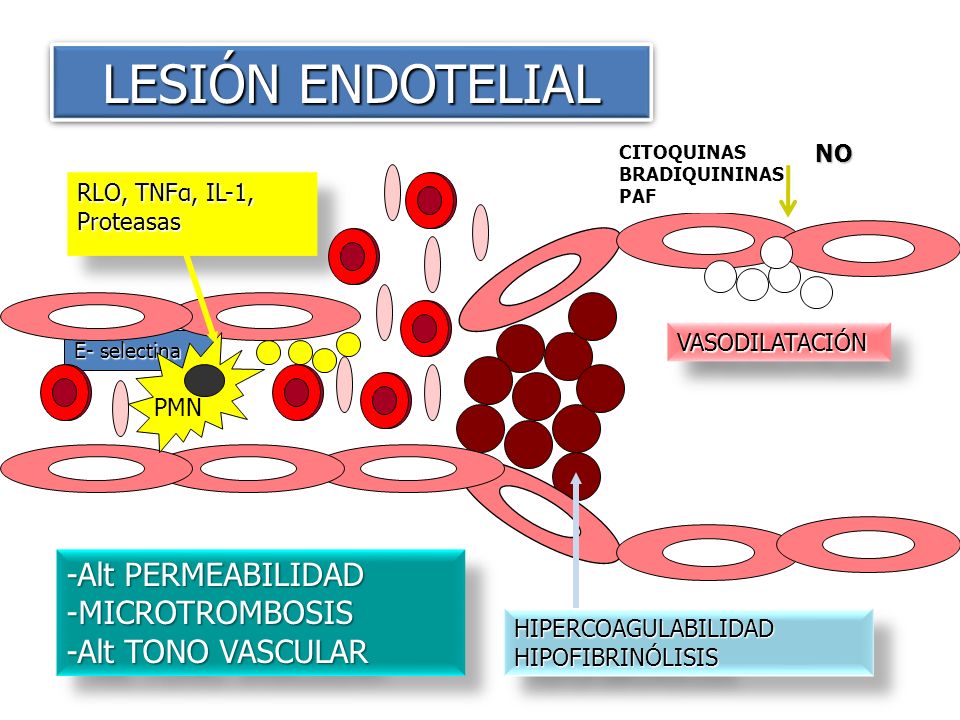
Figura 3. Lesión del endotelio vascular producido por la sepsis. Imagen extraída de https://slideplayer.es/slide/7103653/
Todo este desorden sistémico afecta a diferentes órganos. Los signos y síntomas clínicos son inespecíficos, varian entre los distintos individuos y pueden superponerse a las enfermedades subyacentes. Las distintas manifestaciones clínicas que podemos encontrar son [12, 17].
- Cardiovasculares y hemodinámicas: disminución de resistencias vasculares periféricas con aumento de frecuencia cardiaca y del gasto cardiaco secundariamente. TAS < 100 mmHg o TAM < 65 mmHg. Hasta en un 25% de los casos se puede afectar la fracción de eyección izquierda y la función diastólica. El perfil hemodinámico del shock séptico se caracteriza por compartir rasgos de los siguientes modelos de shock:
- Hipovolémico, por pérdida del llenado cardíaco, bien sea por extravasación capilar (hipovolemia absoluta) y/o por vasodilatación (hipovolemia relativa).
- Cardiogénico, motivado por una disminución de la capacidad contráctil.
- Obstructivo, ocasionado por el aumento de las resistencias vasculares (especialmente pulmonares).
- Distributivo, debido a la hipoperfusión tisular a pesar de un gasto cardíaco normal o aumentado, por cambios tanto a nivel macrovascular (descenso del flujo sanguíneo esplácnico) como microvascular (establecimiento de regiones con shunt).
- Citotóxico, originado por la incapacidad celular para utilizar oxígeno a pesar de un aporte adecuado.
- Pulmonares y respiratorias: trabajo respiratorio, frecuencia respiratoria > 22 rpm, alteración en la relación ventilación/perfusión, hipoxemia grave arterial (PAFI < 300) y Síndrome de distress respiratorio agudo.
- Neurológicas: Glasgow < 15, desorientación, agitación, síndrome confusional. La presentación más común es encefalopatía sin alteración electroencefalográficas focales. Si encontramos una disfunción multiorgánica precoz es frecuente observar afectación del sistema nervioso periférico.
- Fiebre: es frecuente pero no constante. Es más frecuente en edades extremas, alcohólicos, urémicos y sepsis por bacilos gramnegativos (BGN).
- Renales: oliguria, aumento de la concentración de Creatinina e hiperazoemia. El daño renal puede producirse por distintos mecanismos: necrosis tubular aguda, glomerulonefritis, necrosis cortical, nefritis intersticial, lesión secundaria a fármacos.
- Hematológicas: es frecuente encontrar leucocitosis con neutrofilia. La leucopenia se asocia con peor pronóstico. La trombocitopenia es un hallazgo muy frecuente, también se asocia con la CID, y con aumento del tiempo de Protrombina y de Dímeros D e hipofibrinogenemia. Clínicamente se manifiesta con fenómenos hemorrágicos (piel, mucosas, tracto digestivo, acceso venosos y arteriales), así como trombóticos a nivel de la microcirculación.
- Digestivas: la principal anomalía es la ictericia colestásica, encontramos aumento de Bilirrubina, Fosfatasa alcalina y Transaminasas. El fallo hepático agudo es raro, pero se asocia a un peor pronóstico. Podemos encontrar náuseas, vómitos, diarrea, íleo y hemorragia digestiva por ulceras de estrés.
- Endrocrino-metabólicas: hiperlactacidemia acompañada o no de acidosis metabólica, hiperlipidemia, aceleración del catabolismo proteico, hipoalbuminemia e hiperglucemia. La asociación de hipoglucemia junto a hipotensión refractaria a drogas vasoactivas nos indicaría una insuficiencia suprarrenal. Podemos encontrar también hipotiroidismo e hipopituitarismo relativos.
Todo esto puede desembocar en un Síndrome de disfunción multiorgánica (SDMO), definido como trastornos graves de funcionamiento de dos o más órganos que impiden la posibilidad de mantener la homeostasia sistémica sin intervención terapéutica. La causa más frecuente de SDMO en el paciente crítico es la sepsis, siendo además el SDMO la principal causa de fallecimiento en los pacientes sépticos [18] (Figura 4).
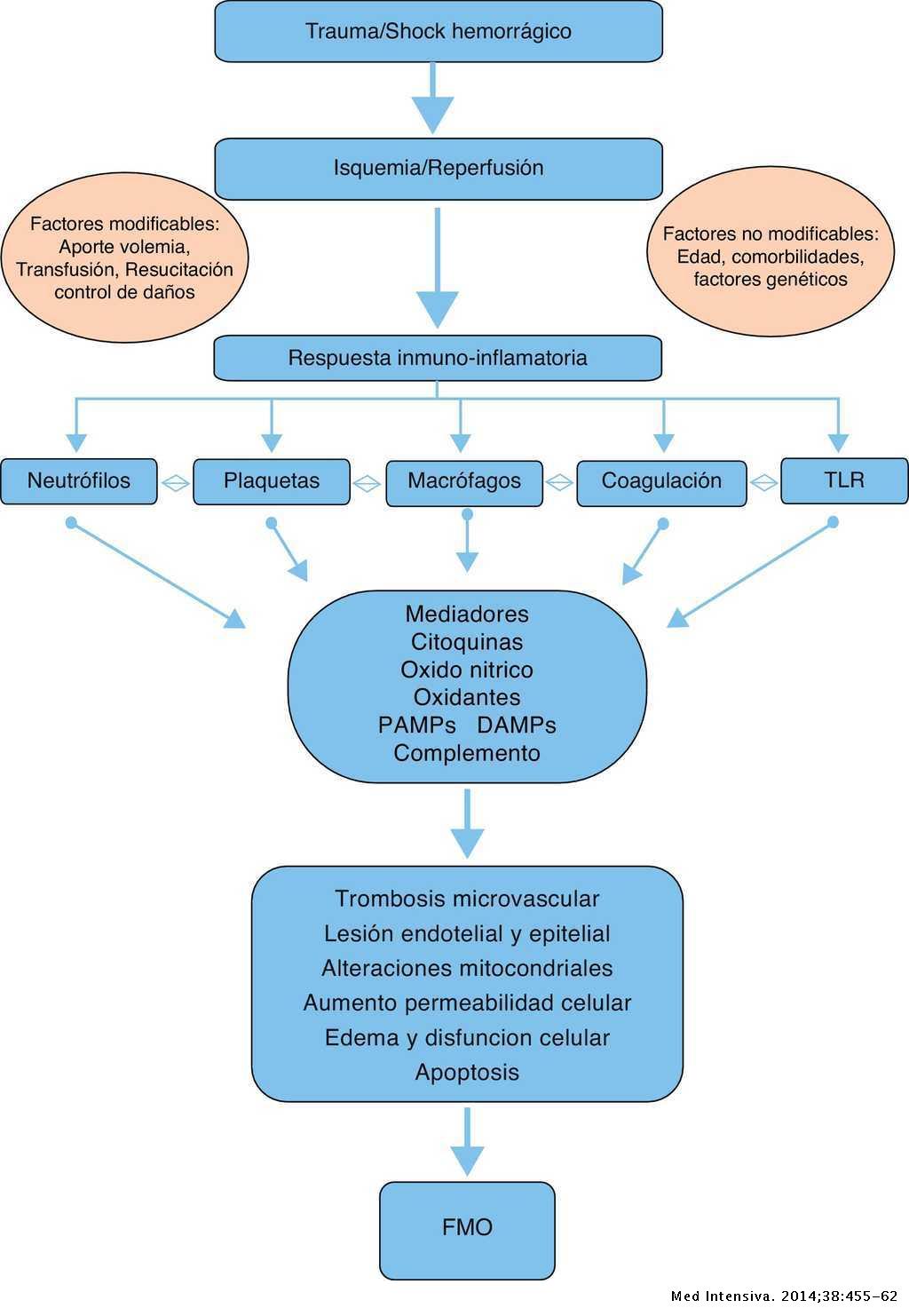
Figura 4. Resumen fisiopatología de la sepsis. Imagen extraída de Llompart-Pou et al.
Referencias
1. Pierrakos C, Vincent JL. Sepsis biomarkers: a review. Crit Care 2010; 14(1):R15.
2. Namas R, Zamora R, Namas R, An G, Doyle J, Dick TE, et al. Sepsis: Something old, something new, and a systems view. J Crit Care 2012; 27(3):314 e311-311.
3. Angus DC, van der Poll T. Severe sepsis and septic shock. The New England journal of medicine 2013; 369(9):840-851.
4. Reinhart K, Bauer M, Riedemann NC, Hartog CS. New approaches to sepsis: molecular diagnostics and biomarkers. Clin Microbiol Rev 2012; 25(4):609-634.
5. García-Conde J, Merino Sánchez J, González Macías J. Patología General. Editorial Marban 2014:1056.
6. Uhle F, Chousterman BG, Grutzmann R, Brenner T, Weber GF. Pathogenic, immunologic, and clinical aspects of sepsis – update 2016. Expert Rev Anti Infect Ther 2016; 14(10):917-927.
7. Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell 2010; 140(6):805-820.
8. Rosin DL, Okusa MD. Dangers within: DAMP responses to damage and cell death in kidney disease. J Am Soc Nephrol 2011; 22(3):416-425.
9. Russell JA. Management of sepsis. The New England journal of medicine 2006; 355(16):1699-1713.
10. Rimmele T, Payen D, Cantaluppi V, Marshall J, Gomez H, Gomez A, et al. Immune Cell Phenotype and Function in Sepsis. Shock 2016; 45(3):282-291.
11. Abbas A, Lichtman A, Pillai S. Inmunología celular y molecular. Elsevier 2018; 9ª edición:576.
12. Sepsis and septic shock. Nat Rev Dis Primers 2016; 2:16046.
13. Chan JK, Roth J, Oppenheim JJ, Tracey KJ, Vogl T, Feldmann M, et al. Alarmins: awaiting a clinical response. J Clin Invest 2012; 122(8):2711-2719.
14. Lee WL, Slutsky AS. Sepsis and endothelial permeability. The New England journal of medicine 2010; 363(7):689-691.
15. Cinel I, Dellinger RP. Advances in pathogenesis and management of sepsis. Curr Opin Infect Dis 2007; 20(4):345-352.
16. Okamoto K, Tamura T, Sawatsubashi Y. Sepsis and disseminated intravascular coagulation. J Intensive Care 2016; 4:23.
17. Suarez Pita D, Vargas Romero JC, Salas Jarque J, Losada Galván I, de Miguel Campo B, Catalán Martín PM, et al. Manual de Diagnóstico y Terapéutica Médica. Hospital Universitario 12 de Octubre. Merck Sharp & Dohme de España (MSD) 2017; 8ª edición:1410.
18. Vincent JL, Nelson DR, Williams MD. Is worsening multiple organ failure the cause of death in patients with severe sepsis? Critical care medicine 2011; 39(5):1050-1055.